
溴素(Bromine)作為一種關鍵的化學元素,在常溫常壓環境下呈現為棕紅色易揮發液態,帶有濃烈的刺激性氣味。其密度為3.119 g/cm3,熔點為-7.2℃,沸點為58.76℃。溴素具有毒性且會對物體產生侵蝕作用,其蒸汽為棕紅色,固態狀態下則展現出黃綠色的金屬光澤。該物質在水中的溶解能力較弱(20℃時溶解度為3.38g/100g水),但能輕松溶解于四氯化碳、乙醇等有機溶劑。化學特性方面,溴素與氯元素相近,可與氫、金屬及非金屬發生反應,但其活躍程度略遜于氯。
在工業生產領域,溴素有著極為廣泛的應用,主要用于制造溴化物、**、染料、熏蒸劑、滅火劑等產品,同時也應用于漂白等相關工藝過程。需要注意的是,即便溴蒸汽濃度極低,也會損傷粘膜組織,引發咳嗽、鼻出血等不適癥狀;液態溴接觸皮膚會造成灼傷,因此在操作過程中,必須穿戴好工作服、手套、濾毒口罩等防護用品,嚴防皮膚直接接觸。
溴素的生產方式種類較多,主要有水蒸氣蒸餾法、空氣吹出法、溶劑萃取法、吸附法以及沉淀法等。在這些工藝中,空氣吹出法與水蒸氣蒸餾法是工業生產中應用**為普遍的兩種。在我國,空氣吹出法的產能占比約為90%,水蒸氣蒸餾法則僅占10%左右。
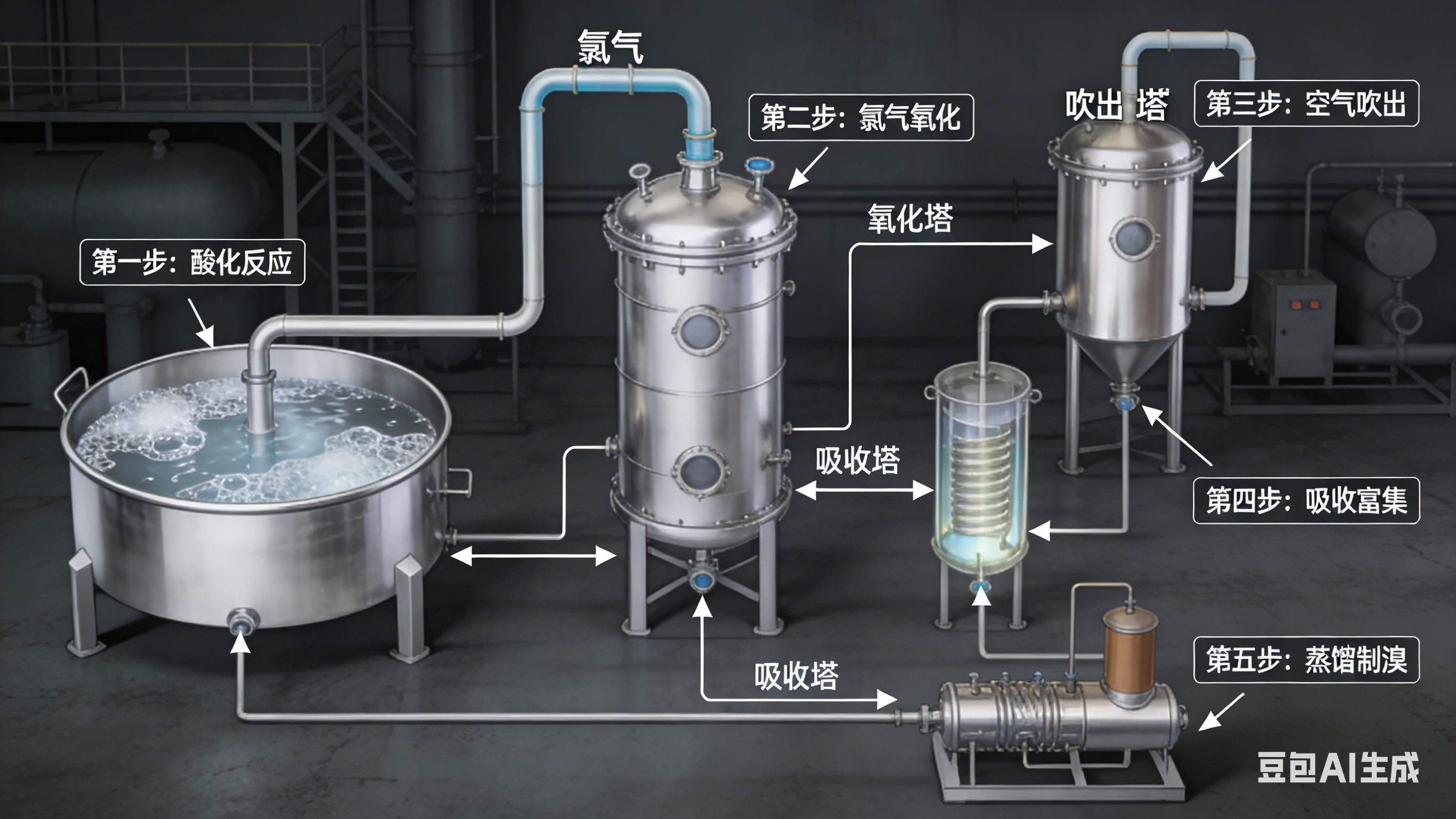
該工藝是目前我國溴素生產的主流方式,其核心原理是在酸性環境下,以氯氣作為氧化劑,將鹵水中的溴離子(Br?)氧化轉化為溴分子(Br?),具體反應式如下:
$$2Br^- + Cl_2 \rightarrow Br_2 + 2Cl^-$$
反應后游離出來的溴分子,會通過空氣吹離體系,這也是該方法被稱為空氣吹出法的原因。在吸收環節,采用二氧化硫與水進行噴霧吸收處理,生成包含HBr和H?SO?的初級酸,反應式為:
$$Br_2 + SO_2 + 2H_2O \rightarrow 2HBr + H_2SO_4$$
隨后,向初級酸中通入氯氣進行二次氧化,使溴再次游離出來,同時生成鹽酸,反應式如下:
$$2HBr + Cl_2 \rightarrow 2HCl + Br_2$$
**后,借助水蒸氣蒸餾工藝對溴進行冷凝分離,**終獲得成品溴。
該工藝的完整流程涵蓋鹵水酸化、氯氣氧化、空氣吹出、二氧化硫吸收、蒸餾以及提純等多個步驟。其優勢在于工藝成熟、溴吹出效率高、利用率高,且產生的廢酸可回收用于鹵水酸化處理,有效減少環境影響和能源損耗。不足之處在于,在北方低溫環境下,溴的提取率會有所下降。
關鍵操作參數如下:
酸化后鹵水的pH值控制在2.9~3.1之間;
氧化階段的配氯率維持在100%~120%;
吹出階段的氣液比控制在100:1~150:1;
吸收階段需確保完成液的含溴量高于45 kg/m3;
蒸餾階段出溴口的溫度保持在80~85℃,且廢液含溴量需低于0.01%。
該方法以苦鹵(制取氯化鉀后的母液)為原料,通過直接蒸餾的方式獲取溴素。其工藝流程相對簡便:將鹵水預熱后從蒸餾塔頂部送入,同時向塔底通入氯氣和蒸汽,使鹵水發生氧化蒸餾反應;溴蒸汽經冷凝處理后分離出粗溴,再通過精餾處理提純,**終得到成品溴。
此工藝具有技術成熟、能耗較低、溴產品純度較高的特點,適合用于溴含量較高的原料,例如美國大湖地區和死海地區的鹵水。但在我國,苦鹵資源存在季節性強、分布分散的問題,這限制了該工藝的大規模推廣應用,因此自20世紀70年代起,空氣吹出法逐步取代其成為我國溴素生產的主導工藝。
該工藝的關鍵操作條件為:酸化后鹵水的pH值控制在2.5~3.5,精餾溫度維持在58~58.5℃。
近年來,行業內出現了基于有機液膜的溴素生產新工藝。該工藝利用煤油等非極性溶劑與聚丙烯等疏水性微孔膜形成液膜,使溴分子通過液膜被氫氧化鈉溶液等堿性吸收液吸收,進而實現溴的分離與富集。
有機液膜法的優勢在于反應條件溫和,對生產設備的侵蝕作用較小,但目前該工藝仍處于試驗研究階段,尚未實現大規模工業化生產。
在選擇溴素生產工藝時,需**考量原料來源、經濟效益、環境相容性及技術可行性等多方面因素,具體應遵循以下原則:
結合地域特點,優先選用易得原料,降低生產成本;
優先選擇反應條件溫和、對設備侵蝕性小的工藝;
重視環境保護,減少廢氣、廢水、廢渣的排放;
在現有成熟工藝的基礎上,加大新技術研發力度,提升溴素產量與市場競爭力。
總體來看,隨著全球溴素供需格局的變化及技術的不斷進步,溴素生產行業正朝著節能化、環保化的方向穩步發展,以更好地滿足工業生產與環境保護的雙重需求。
